Оригінал на сайті tulane.edu
Хіміотерапія є основним засобом лікування протозойних інфекцій. Успішна хіміотерапія значною мірою залежить від здатності використовувати метаболічні відмінності збудника та інфікованого організму. Проблема, що постає перед хіміотерапією — це здатність збудника мутувати і ставати стійким до лікарських засобів. Конкретні приклади, механізми дії і резистентності до лікарського засобу розглядаються нижче.
- Дія препарату
- Хлорохін і травна вакуоль
- Антифолати
- Препарати, що застосовують окисно-відновні механізми
- Резистентність до лікарських засобів
- Хлорохін
- Інші посилання
Дія лікарського препарату
| Вибіркова токсичність |
|
Лікарські препарати діють шляхом специфічної взаємодії з клітинними або біохімічними процесами, які часто називають «мішенями». Класичним прикладом мішені для лікарського препарату є фермент, який інгібується препаратом. Ефективні препарати проявлятимуть селективну токсичність щодо збудника у порівнянні з організмом-носієм. Вказаній селективній токсичності сприяють численні фактори (Таблиця), і ці фактори не взаємовиключають один одного. Доцільний формат лікарського препарату спрямований на використання цих різних факторів для розробки препаратів, які будуть високотоксичними для збудника і водночас демонструватимуть мінімальну токсичність для інфікованого організму.
Хлорохін і травна вакуоль
Травна вакуоль — це лізосомоподібна органела, в якій відбувається розпад гемоглобіну і детоксикація гему (див. більш детальний розгляд травної вакуолі). Хлорохін накопичується у травній вакуолі паразита в розмірі, кратному до кількох тисяч. Можливими механізмами такого селективного накопичення хлорохіну в травній вакуолі є: 1) протонування та утримання хлорохіну іонами через низький рН травної вакуолі; 2) активне поглинання хлорохіну переносником(ами) паразиту; та/або 3) зв’язування хлорохіну з конкретним рецептором у травній вакуолі.
Точне застосування вказаних трьох ймовірних механізмів не зрозуміле, але загальновизнано, що хлорохін виявляє свій токсичний ефект шляхом взаємодії, перетворюючи вільний гем на гемозоїн. Внаслідок перетравлення гемоглобіну в травній вакуолі у великій кількості вивільняюється гем. Вільний гем може руйнувати мембрани, призводити до генерації інтермедіатів, здатних до реакцій з оксигеном і інгібувати багато інших процесів а, відтак, є досить токсичним. Гем детоксикується у травній вакуолі з допомогою процесу біокристалізації, під час якого гем ізолюється у великі нерозчинні кристали, які називаються гемозоїном або гемомеланіном [див. більш детальний опис про утворення гемозоїну]. Точний механізм, з допомогою якого хлорохін пригнічує утворення гемозоїну, не відомий, проте хлорохін може зв’язувати гем, і це зв’язування може запобігти процесу з’єднання гему в кристал гемозоїну. Таким чином, знищення паразитів є результатом накопичення метаболічних відходів (тобто гему), пов’язаних з перетравленням гемоглобіну.
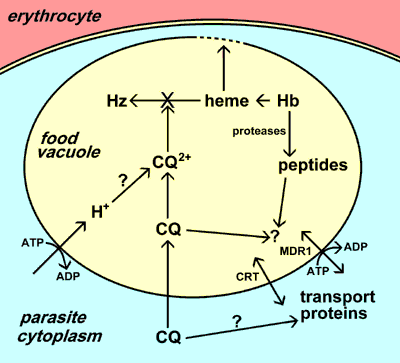 |
| Хлорохін (CQ) накопичується в травній вакуолі паразита. Це накопичення може включати утримання іонами після протонування, специфічного транспорту і/або зв’язування з рецептором (наприклад, з гемом). Основною дією хлорохіну є пригнічення утворення гемозоїну (Hz) з гему, що виділяється при перетравленні гемоглобіну (Hb). Потім вільний гем руйнує мембрани і призводить до смерті паразитів. Стійкість до хлорохіну обумовлена зниженням накопичення хлорохіну в травній вакуолі. До опору були залучені два різних транспортери (CRT і MDR1). Функції цих транспортерів та їх точні ролі в стійкості до хлорохіну не відомі. |
Інші хіноліни, що містять антималярійні засоби, такі як мефлохін і хінін, також, очевидно, впливають на травну вакуоль. Проте залишається незрозумілим: ці лікарські препарати зв’язують геми чи впливають на утворення гемозоїну. Більше того, ці препарати є слабшими основами, ніж хлорохін, і в травній вакуолі можуть не проявляти таку ж інтенсивність утримання іонами.
Травна вакуоль передбачає багато потенційного застосування мішеней лікарського засобу. На додаток до інгібування утворення гемозоїну, яке описане вище, специфічні інгібітори протеаз, що беруть участь у перетравленні гемоглобіну, також досліджуються як потенційні засоби проти малярії. [див. більш детальний опис протеаз травної вакуолі] Спеціалізовані функції розщеплення гемоглобіну і утворення гемозоїну є унікальними для паразита і не зустрічаються в інфікованого організму. Крім того, обидві функції — генерація амінокислот з гемоглобіну та детоксикація гему — дуже важливі для паразита.
Антифолати
Метаболізм фолатів є мішенню декількох протималярійних препаратів, а також препаратів, що застосовуються проти інших патогенів. Зменшені фолати служать супутніми факторами в багатьох реакціях перенесення вуглецю, що беруть участь у біосинтезі амінокислот і нуклеотидів (див. докладніше вітаміни і супутні фактори). Через високу швидкість реплікації малярійний паразит має значні вимоги до нуклеотидів в якості попередників для синтезу ДНК (див. детальніше нуклеотиди і нуклеїнові кислоти), і тому є особливо чутливим до антифолатів. Двома основними мішенями антифолатного метаболізму є первинний біосинтез фолатів і дигідрофолатредуктази (DHFR).
Малярійний паразит синтезує фолати de novo, тоді як інфікований організм людини повинен отримувати завчасно сформовані фолати і не може синтезувати фолат. Нездатність паразита використовувати екзогенні фолати робить біосинтез фолатів хорошою мішенню для препарату. Фолат синтезують з 3 основних складових: GTP, p-амінобензойної кислоти (pABA) і глутамату, включаючи 5 ферментів. Один з цих ферментів, дигідроптероатсинтаза (DHPS), інгібується сульфаміламідними препаратами. Сульфадоксин і дапсон є двома загальними протималярійними засобами, які націлені на DHPS. Сульфані препарати є структурними аналогами pABA і перетворюються в аддукти DHPS, які не піддаються метаболізму. Це призводить до виснаження пулу фолатів і тим самим знижує кількість тиміділата, доступного для синтезу ДНК.
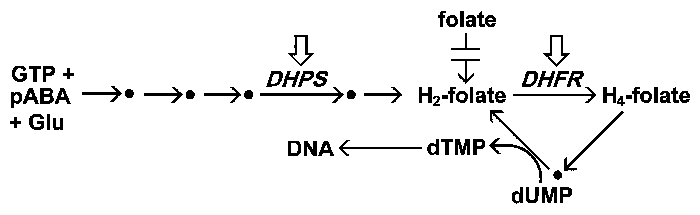 |
| Спрощена схема метаболізму фолатів. Малярійний паразит синтезує фолати de novo, але не може використовувати утворені фолати. Фолати беруть участь в якості супроводжуючих факторів у багатьох біосинтетичних процесах. Особливо слід відзначити синтез тиміділату (dTMP), необхідного для синтезу ДНК. Дві головні мішені антималярійних препаратів, ціллю яких є метаболізм фолієвої кислоти, позначаються у таблиці стрілками. |
DHFR є повсюдним ферментом, який бере участь у рециркуляції фолатів шляхом відновлення дигідрофолата до тетрагідрофолата. Потім тетрагідрофолат окислюють назад до дигідрофолату, оскільки він бере участь у біосинтетичних реакціях (наприклад, TYMS). Інгібування DHFR запобігає утворенню тиміділату і призводить до затримки синтезу ДНК і до подальшої загибелі паразитів. Пириметамін і прогуаніл — це два найпоширеніші інгібітори DHFR, які використовуються в якості протималярійних препаратів. Ці препарати інгібують DHFR паразита в більшій мірі, ніж фермент організма-носія, і таким чином виявляють селективну токсичність щодо паразиту.
| Антифолатні комбінації |
|
| Лікарські препарати
піриметамін + сульфадоксин(або дапсон) триметоприм (або піриметамін) + сульфадиазин триметоприм + сульфаметоксазол |
Патогени
Plasmodium Toxoplasma Cyclospora, Isospora, Pneumocystis
|
Найчастіше інгібітори DHPS і DHFR використовуються в комбінації (в таблиці) для синергічного ефекту і для уповільнення розвитку опору препарату. Специфічні точкові зміни в цих ферментах призводять до зниження спорідненості до препаратів. Опір має тенденцію швидко розвиватися в присутності тиску препарату в ситуаціях, коли одна мутація може призвести до стійкості до лікарських засобів. Використання комбінацій лікарських засобів буде сповільнювати розвиток резистентності, оскільки повинні виникати дві незалежні мутації для розвитку резистентності до обох препаратів. Фансидар, комбінація сульфадоксину і піріметаміну, широко використовується для лікування неускладненої малярії falciparum. Триметоприм, подібний до піріметаміну, застосовують зазвичай у поєднанні з іншими сульфаміламідними препаратами для лікування кокцидій (Toxoplasma, Cyclospora, Isospora) і Pneumocystis.
| Можливі окислювально-відновлювальні агенти | |
| Лікарські препарати
примахін, похідні артемізиніну метронідазол, тинідазол бензндизол, ніфуртімокс
|
Патогени
Plasmodium Giardia, Entamoeba, Trichomonas Trypanosoma cruzi
|
Препарати, які застосовують механізми окислювально-відновлювальних реакцій
Вважається, що кілька антипротозойних препаратів діють через окислювальний стрес (таблиця). Метаболічні процеси будуть виробляти реактивні проміжні кислоти (ROI), які можуть пошкодити такі клітинні компоненти, як ліпіди, білки та нуклеїнові кислоти (див. статтю окислювальний стрес). Висока метаболічна активність більшості протозойних патогенів призведе до виробництва ще більш високих рівнів ROI. Прикладом цього є паразит малярії, який виробляє ROI внаслідок перетравлення гемоглобіну та вивільнення вільного гему [див. докладніше статтю гем і ROI]. У всіх клітинах є механізми, за допомогою яких може бути детоксикований ROI (наприклад, окисно-відновний метаболізм). Препарати, які підвищують рівень оксидативного стресу в паразита, можуть перекрити ці механізми захисту РОІ і призвести до смерті паразитів. Рівень оксидативного стресу можуть бути збільшений за рахунок препаратів, які є прямими окислювачами, а також лікарськими препаратами, які брали участь в окисно-редукційному циклі, що іноді називають поверхневим окислювально-відновним циклом.
Багато препаратів, що беруть участь у окислювально-відновних реакціях, повинні бути активовані ще до того, як вони будуть застосовані проти своїх цілей. Наприклад, метронідазол та інші нітроімідазоли є лікарськими засобами широкого спектру дії, які впливають на широкий спектр анаеробних бактерій і найпростіших. Ці препарати активуються шляхом відновлення нітрогрупи до аніонного радикала. Аніонний радикал має високу реакційну здатність і утворює допоміжні речовини з білками і ДНК, що призводить до втрати функції. Зокрема, реакції з ДНК призводять до розриву ланцюга і інгібування реплікації і призводять до загибелі клітин. Скорочення нітроімідазолів вимагає значимих відновлювальних умов, а анаеробні організми мають більший потенціал зниження, ніж аеробні організми. Це пояснює селективність цих сполук для анаеробних організмів. Інакше кажучи, препарати активуються переважно патогенами.
У випадку метронідазолу відновлений ферредоксин стає первинним постачальником електронів, відповідальним за його зниження (рис.). Існує хороша кореляція між наявністю піруват-ферредоксин оксидоредуктази (PFOR) і чутливістю до метронідазолу. У всіх трьох найпростіших, уражених метронідазолом (в таблиці), Відсутні мітохондрії і PFOR подібно до тих, що зустрічаються у багатьох анаеробних бактерій. Аеробні організми з мітохондріями використовують піруватдегідрогеназу замість PFOR для виробництва ацетил-коферменту А.
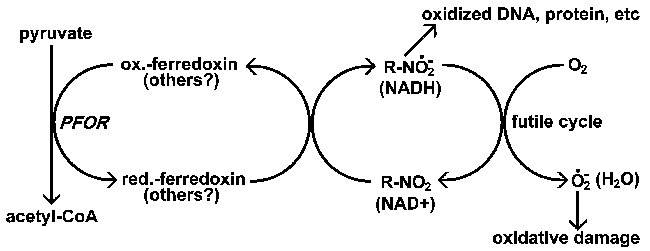 |
| Дії нітроімідазолів. Нітроімідазоли (R-NO2) активуються паразитом через відновлення до аніонного радикала. Цей високоактивний аніон-радикал пошкодить ДНК і білки, що призводить до смерті паразитів. Метронідазол специфічно знижується ферредоксином у випадку з Giaridia, Entamoeba, and Trichomonas. Аеробні організми використовують інших донорів електронів для зниження рівня нітроімідазолів; також існує можливість встановити безглузді цикли, що призводять до генерації ROI, де кисень є кінцевим акцептором електронів. Зазвичай NAD оксидоредуктази здійснюють окислювально-відновлюючий цикл де кінцевим продуктом є вода. |
Нітроімідазоли (наприклад, бензндизол) та споріднені сполуки нітрофурану (наприклад, ніфуртімокс) також ефективні проти Trypanosoma cruzi. Донори електронів, відповідальні за початкове відновлення цих препаратів, не відомі, і основа для специфікації під паразита не зрозуміла. Обидва ці препарати є дещо токсичними і не мають хороших терапевтичних показників. Вважається, що механізм дії ніфуртімокса пов’язаний з поверхневим окислювально-відновним циклом згідно його зменшенню, тоді як припускається, що бензндизол пригнічує специфічні редуктази і тим самим знижує здатність паразита видалити ROI.
|
Окислювальний стрес і дефіцит G6PD Відомо, що деякі генетичні захворювання людини надають певний захист від малярії (див. вроджена резистентність). Глюкозо-6-фосфатдегідрогеназні (G6PD) дефіцитні індивідууми у своїх еритроцитах будуть мати більш низький рівень зниженого NADPH, які необхідні для підтримки зниженого глутатіону. Більш низький рівень відновленого глутатіону призведе до підвищеної чутливості до окислювального стресу, оскільки глутатіонпероксидаза бере участь у детоксикації ROI. Збільшення рівня ROI через метаболізм паразита в поєднанні зі зниженням здатності еритроцитів (дефіцитних до G6PD) видаляти ROI призведе до передчасного руйнування інфікованого еритроциту і, таким чином, надасть певний захист від малярії. Паразит не тільки повинен захищати себе від ROI, але також повинен гарантувати, що еритроцит носія не пошкодиться до того, як паразит завершить еритроцитарну шизогонію. Фактично, було запропоновано, що паразит може забезпечити еритроцити господаря глутатіоном для збільшення його відновлювальної здатності. Дещо пов’язаним із цим є лікування примакіном, яке протипоказано пацієнтам з G6PD-дефіцитом, оскільки він може викликати гемолітичну анемію. Це, ймовірно, пов’язане зі здатністю примакіну генерувати ROI та знижений потенціал зниження еритроцитів, дефіцитних до G6PD. |
Резистентність до лікарських препаратів
Виникнення лікарської стійкості сильно обмежує арсенал доступних препаратів проти протозойних патогенів. Паразити виробили численні шляхи подолання токсичності лікарських засобів (таблиця). Досить часто лікарська резистентність включає мутації в цільовому препараті, так що лікарський засіб також не зв’язується або не інгібує мішень.
| Механізми опору |
|
Резистентність до лікарських препаратів може швидко розвиватися в ситуаціях, коли одна точкова мутація може надавати стійкість. Інший механізм стійкості до лікарських засобів включає вираження більш високих рівнів мішені. Це може бути здійснено або за допомогою посиленої транскрипції і трансляції або ампліфікації гена. Це призводить до необхідності більш високих рівнів ліків для досягнення такого ж рівня інгібування. Зменшення накопичення лікарських засобів або метаболізму препарату до нетоксичних продуктів призведе до того, що менше ліків досягне мети і може також сприяти стійкості до лікарських засобів. Резистентність до лікарського засобу може також включати накопичення мутацій в тих же або інших мішенях, які будуть мати адитивні або синергічні ефекти. Паразити з мутаціями або генетичними поліморфізмами, які надають зменшення чутливості до препарату, будуть відбиратись під тиском препарату.
Білки і мутації, пов’язані з резистентністю до лікарських препаратів
| Білки і мутації, пов’язані з резистентністю до лікарських препаратів | |||||||||||||||||||||||||||||||||||
Білки: CRT = транспортер стійкості до хлорохіну; MDR1 = множинна лікарська стійкість (гомолог P-глікопротеїну); DHFR = дигідрофолат редуктази; DHPS = дигидротетраметилсинтетаза; ATPase6 = сарко / ендоплазматичний ретикулум кальцієво-залежний ортолог ATPase. * Пов’язана з підвищеною чутливістю до мефлохіну і дигідроартемізиніну і зниженою чутливістю до хлорохіну. |
У деяких випадках специфічні мутації були пов’язані з стійкістю до лікарських засобів (табл.). Резистентність до Фансидару (SP) корелює зі специфічними мутаціями ферментів, що піддаються впливу сульфадоксоїну і піриметаміну (дигідротерози ситетази і дигідрофолатредуктази, відповідно). Резистентність до хлорохіну (більш детально обговорюється нижче) корелюється з мутаціями в транспортері, знайденому на мембрані травної вакуолі (транспортер хлорохінового опору, CRT). Інший транспортер травної вакуолі, ген мульти-лікарської стійкості 1 (MDR1), повинен відігравати додаткову роль в резистентності. Основа стійкості до мефлохіну та хініну не зрозуміла, але ген mdr1 був залучений також.
Хлорохін. Резистентність до хлорохіну пов’язана зі зменшенням кількості хлорохіну, що накопичується в травній вакуолі, ділянці дії хлорохіну (див. вище). Механізм такого зниження накопичення є спірним. Деякі дослідження показали, що зменшення накопичення ліків відбувається за рахунок збільшення викиду препарату. У той час як інші дослідження показують, що зниження рівня накопичення хлорохіну є більш важливим. Спостереження, що верапаміл і пов’язані з ним препарати можуть змінити стійкий до хлорохіну фенотип, призвело до припущень, що АТР-залежний транспортер відіграє певну роль у витіканні ліків та стійкості до хлорохіну, подібно до множинної лікарської стійкості (MDR) при раковому захворюванні. MDR-подібний транспортер, позначений PfMDR1, був ідентифікований на мембрані травної вакуолі. Проте не було продемонстровано жодних кореляцій між PfMDR1 і стійкістю до хлорохіну. Допоміжну роль для PfMDR1 у стійкості до хлорохіну не можна виключити.
Дослідження генетичного перехресного та картографування між клоном, стійким до хлорохіну, і клокуин-чутливим клоном призвели до ідентифікації області 36 kb на хромосомі 7, пов’язаної зі стійкістю до хлорохіну. Один з 10 генів у цій 36-кілометровій області кодує білок з 10 трансмембранними доменами і нагадує білок-транспортер, подібний до хлоридних каналів. Ген був позначений як pfcrt, а білок локалізований на мембрані травної вакуолі і. Деякі мутації гена pfcrt показують кореляції з фенотипом стійкості до хлорохіну та однієї мутації, заміщення треоніна (T) на лізин (K) на залишку 76 (K76T) показує досконалу кореляцію з стійкістю до хлорохіну. Імовірно, ці мутації впливають на накопичення хлорохіну в травній вакуолі, але точний механізм стійкості до хлорохіну не відомий. Крім того, спостереження, що стійкість хлорохіну виникло порівняно кілька разів, а потім згодом поширилося, призвело до спекуляцій, що численні гени беруть участь у розвитку резистентності (див. більше коментарів).
Додаткова література
- Фоллі М і Тіллі Л (1998). Механізми дії та опору, а також перспективи нових агентів. Фармакологія та терапія 79:55
- Хайді Дж. Е. (2007) Малярія, резистентна до ліків — інсайт. FEBS Journal 274, 4688-4698.
- Ouellette M (2001) Біохімічні та молекулярні механізми резистентності паразитів до препаратів. Trop Med Int Здоров’я 6: 874.
- Розенталь П.Я. і Голдсміт Р.С. (2001) Антипротозойні препарати. У базовій та клінічній фармакології 8-е видання. McGraw-Hill Companies Inc. (онлайн видання доступні через Stat!Ref Books в Tulane Medical Library)
- Самуельсон Дж. (1999) Чому метронідазол є дієвим проти бактерій і паразитів. Антимікробні агенти Chemother. 43: 1533.
- Веллемс Т.Е. та Плові К. С. (2001) Малярія, стійка до хлорохіну. J Inf Dis 184:770.

Добавить комментарий